注意:此页面搜索的是所有试题
佳木斯大学语言治疗学
酸碱质子理论认为,凡能给出质子的物质都是碱。
·true
·false
基态Na原子的最外层电子的四个量子数是3,1,0,1/2。
·正确
·错误
根据质子理论,两性物质溶液的pH值与两性物质的浓度绝对无关。 ( )
·正确
·错误
下列因素中,与非电解质溶液的渗透压有关的是()
·溶液的温度
·溶液的体积
·溶质的性质
·溶液的浓度
对配位化合物〔Zn(NH3)4〕(OH)2下列表述正确的是()
·中心原子是Zn
·配位体是NH3
·配位数是4
·配离子的电荷是+2
可逆反应Xe( )+2F2( ) XeF4( )的正反应为放热反应,在一定条件下达到平衡后,为了使平衡向逆反应方向移动,则可采取的措施是()
·分离出部分Xe
·扩大容器体积
·升高温度
·分离出部分XeF4
下列电负性大小变化顺序正确的是 ( )
·Rb < S< Si < S < Cl
·Z> Cd > Hg
·F >
·Na < Mg < Al < Si < P < S < Cl
·K < Ca < Sc < Ti < V < Cr < Mn
三种短周期元素 X、Y、Z , X 最外层只有一个不成对电子 ,Y 的次外层为 2个电子 ,最外层有 2 对成对电子 , Z 的全部核外电子有 2 对成对电子和 3 个不成对电子 ,则三种元素所组成的化合物中哪是不可能的 ( )
·XZY3 ;
·X 3Z ;
·XZY2 ;
·X2 ZY;
·X3 ZY 4 ;
在BeCl2中,Be原子以sp杂化轨道与Cl原子成键,其分子的空间构型是( )
·平面三角形
·直线形
·正四面体
·正方形
·V型
乙二胺四乙酸的缩写是( )
·EDTA
·ox
·en
·py
·TA
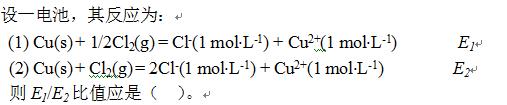
·1
·0.5
·0.25
·2
室温下,0.1mol/L HAc 水溶液中水的离子积常数KW为( )
·1.0 × 10-4
·1.0× 10-10
·1.0 × 10-14
·1.0 × 10-7
·1.0 ×10-8
在纯水中,加入少量碱,其溶液的 ( )
·[H+]与[OH-]乘积变大
·[H+]与[OH-]乘积变小
·[H+]与[OH-]乘积不变
·[H+]等于[OH-]
·以上说法都不对
下列关于溶液酸碱性的说法中,错误的是( )
·溶液pH越大,其碱性越强
·溶液中OH-越多,其碱性越弱
·溶液中H+越多,其酸性越强
·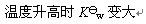
已知AgCl的溶度积常数为Ksp,[Ag(NH3)2]+的稳定常数为Ks,则反应AgCl(s) + 2 NH3 = [Ag(NH3)2]+ + Cl-的平衡常数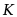 为
为
·KsKsp
·1/ KsKsp
·Ks/Ksp
·Ksp/Ks
·true
·false
基态Na原子的最外层电子的四个量子数是3,1,0,1/2。
·正确
·错误
根据质子理论,两性物质溶液的pH值与两性物质的浓度绝对无关。 ( )
·正确
·错误
下列因素中,与非电解质溶液的渗透压有关的是()
·溶液的温度
·溶液的体积
·溶质的性质
·溶液的浓度
对配位化合物〔Zn(NH3)4〕(OH)2下列表述正确的是()
·中心原子是Zn
·配位体是NH3
·配位数是4
·配离子的电荷是+2
可逆反应Xe( )+2F2( ) XeF4( )的正反应为放热反应,在一定条件下达到平衡后,为了使平衡向逆反应方向移动,则可采取的措施是()
·分离出部分Xe
·扩大容器体积
·升高温度
·分离出部分XeF4
下列电负性大小变化顺序正确的是 ( )
·Rb < S< Si < S < Cl
·Z> Cd > Hg
·F >
·Na < Mg < Al < Si < P < S < Cl
·K < Ca < Sc < Ti < V < Cr < Mn
三种短周期元素 X、Y、Z , X 最外层只有一个不成对电子 ,Y 的次外层为 2个电子 ,最外层有 2 对成对电子 , Z 的全部核外电子有 2 对成对电子和 3 个不成对电子 ,则三种元素所组成的化合物中哪是不可能的 ( )
·XZY3 ;
·X 3Z ;
·XZY2 ;
·X2 ZY;
·X3 ZY 4 ;
在BeCl2中,Be原子以sp杂化轨道与Cl原子成键,其分子的空间构型是( )
·平面三角形
·直线形
·正四面体
·正方形
·V型
乙二胺四乙酸的缩写是( )
·EDTA
·ox
·en
·py
·TA
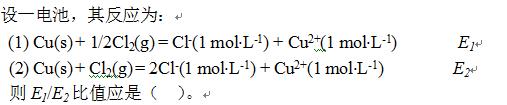
·1
·0.5
·0.25
·2
室温下,0.1mol/L HAc 水溶液中水的离子积常数KW为( )
·1.0 × 10-4
·1.0× 10-10
·1.0 × 10-14
·1.0 × 10-7
·1.0 ×10-8
在纯水中,加入少量碱,其溶液的 ( )
·[H+]与[OH-]乘积变大
·[H+]与[OH-]乘积变小
·[H+]与[OH-]乘积不变
·[H+]等于[OH-]
·以上说法都不对
下列关于溶液酸碱性的说法中,错误的是( )
·溶液pH越大,其碱性越强
·溶液中OH-越多,其碱性越弱
·溶液中H+越多,其酸性越强
·
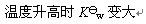
已知AgCl的溶度积常数为Ksp,[Ag(NH3)2]+的稳定常数为Ks,则反应AgCl(s) + 2 NH3 = [Ag(NH3)2]+ + Cl-的平衡常数
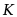 为
为·KsKsp
·1/ KsKsp
·Ks/Ksp
·Ksp/Ks